Spectre UV-visible
La spectroscopie UV-visible est une méthode d’analyse et d’identification des espèces chimiques.
Pour obtenir un spectre UV-visible, on utilise une radiation électromagnétique d’intensité $I_0$ et de longueur d’onde $\lambda$ qui traverse une cuve contenant la solution chimique à analyser et on mesure l’intensité sortante $I$.
Si la longueur d’onde de la radiation électromagnétique est inférieure à 380 nm, alors elle appartient au domaine de l’ultraviolet.
Si elle est comprise entre 380 nm et 780 nm, alors elle appartient au domaine du visible.
Le principe de la spectroscopie UV-visible est de comparer l’intensité sortante par rapport à l’intensité entrante. Afin d’y parvenir, il est nécessaire d’introduire une nouvelle grandeur, l’absorbance, définie par $A_{\lambda} = \log \left( \dfrac{I_0}{I} \right)$. Ainsi, plus l’absorbance est grande, plus l’espèce chimique a absorbé cette radiation.
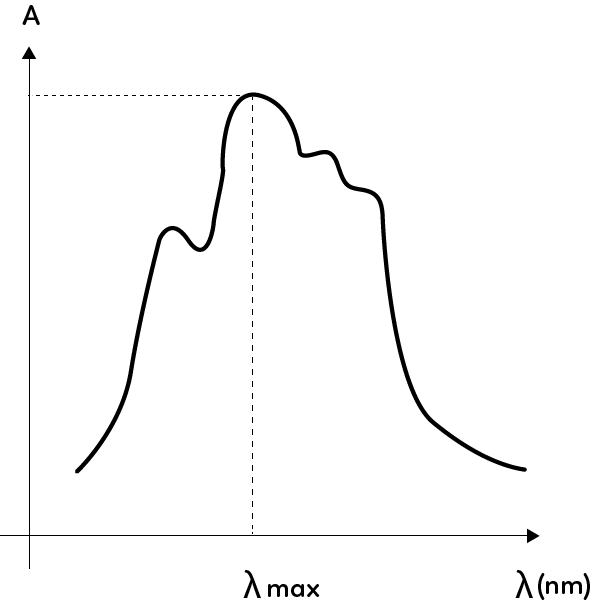
On peut établir le spectre d’absorbance de la solution qui consiste à faire varier la longueur d’onde de la radiation électromagnétique et de calculer pour chaque mesure l’absorbance associée. Ce dernier permet d’obtenir la longueur d’onde correspondant au maximum d’absorption, que l’on note $\lambda_{max}$, et que l’on trouve en lisant la valeur de l’abscisse du maximum d’absorbance.
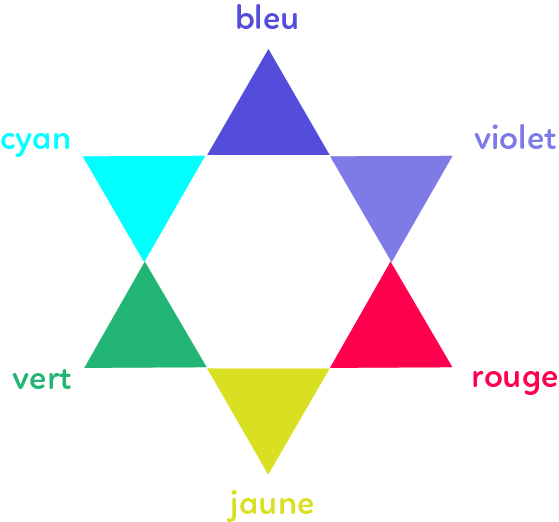
La couleur de l’espèce chimique correspond à la couleur complémentaire de la couleur correspondant à $\lambda_{max}$. Si $\lambda_{max} = 530 $ nm, ce qui correspond à la couleur vert, alors la solution apparait de la couleur diamétralement opposée au vert sur l’étoile chromatique: le violet.
Il existe des groupements d’atomes qui possèdent une longueur d’onde d’absorption maximale caractéristique : les chromophores, comme le groupement –NH$_2$ avec $\lambda_{max} = 195$ nm.
Ainsi, si on trouve un λmax égal à 195 nm, on peut dire qu’il y a probablement un groupement amine dans la molécule. Il existe des tables répertoriant les longueurs d’onde maximales en fonction des groupements caractéristiques qu’il n’est pas nécessaire de connaître par cœur car elles seront fournies pour résoudre les exercices.
Enfin, plus le nombre de doubles liaisons en position conjuguées augmente, plus la longueur d’onde du maximum d’absorption augmente. Deux doubles liaisons sont en position conjuguées si elles sont séparées par une liaison simple. Par exemple : – CH = CH – CH = CH -.
Spectre IR
Spectre IR
La spectroscopie infrarouge est une méthode d’analyse et d’identification des espèces chimiques.
Pour obtenir un spectre IR, on utilise une radiation électromagnétique d’intensité $I_0$ et de longueur d’onde $\lambda$ qui traverse une cuve contenant la solution chimique à analyser et on mesure l’intensité sortante $I$ que l’on compare à $I_0$.
De plus, la longueur d’onde est supérieure à 780 nm environ : c’est le domaine des infrarouges.
On utilise la transmittance $T$ qui évalue en pourcentage le rapport de l’intensité sortante sur l’intensité rentrante. Si on trouve $T = 100 %$, l’intégralité de la radiation a traversé la cuve: l’espèce chimique ne l’a pas absorbée. Si à l’inverse on obtient $T = 0%$, l’espèce chimique a entièrement absorbé cette radiation.
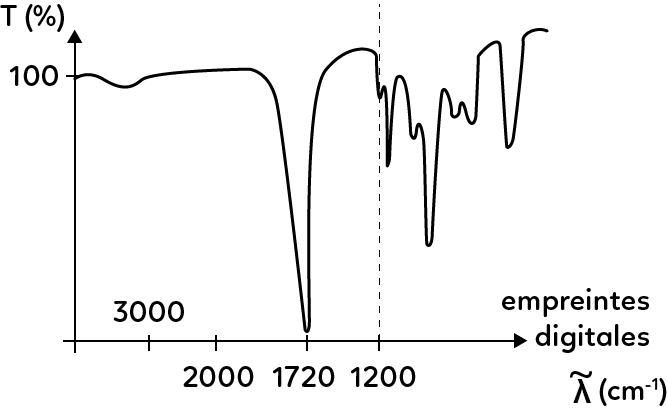
L’axe des abscisses du spectre de transmittance est exprimé en nombre d’onde, défini par $ \sigma = \dfrac{1}{\lambda} $. Par convention, la longueur d’onde $\lambda$ est exprimée en cm, par conséquent, l’unité du nombre d’onde sera cm$^{-1}$.
On prêtera une attention particulière à l’axe des abscisses, gradué de droite à gauche.
Le spectre peut se diviser en deux parties.
La première correspond aux nombres d’onde inférieurs à 1200 cm$^{-1}$. Il s’agit de l’empreinte digitale de la molécule, qui est une partie assez complexe à analyser et qui ne le sera que très rarement.
La seconde est définie par un nombre d’onde supérieur à 1200 cm$^{-1}$ et est caractérisée par des bandes correspondant à des groupements caractéristiques, répertoriées dans des tables.
Par exemple :
– pour le groupement cétone ($C = O$), la bande sera située entre 1705 et 1725 cm$^{-1}$.
– pour le groupement aldéhyde, on trouvera sur le spectre une bande située entre 1720 et 1740 cm$^{-1}$ pour la double liaison $C = O$ et une bande entre 2650 et 2830 cm$^{-1}$ pour la liaison $C – H.$
– pour la fonction alcool, il faudra distinguer selon que le groupement $-OH$ est lié (cas où les alcools sont très concentrés conduisant à des liaisons hydrogènes intermoléculaires et à une bande plus large et de plus petit nombre d’onde) ou libre (cas où l’alcool est peu concentré).


