Acides et bases
Il existe des solutions aqueuses acides, basiques ou neutres. Pour savoir si une solution est acide, basique ou neutre, on mesure le pH. Pour mesurer le pH, il y a deux possibilités :
– Déposer une goutte sur le papier pH à l’aide d’une pipette, et ensuite comparer la couleur du papier pH avec le code couleur qui attribue une valeur du pH à chaque couleur.
– Utiliser un pH-mètre, plus précis. On le plonge directement dans la solution à tester et le pH apparaît sur le cadran numérique.
Si le pH est inférieur à 7, la solution est acide.
Si le pH est égal à 7, la solution est neutre.
Si le pH est supérieur à 7, la solution est basique.
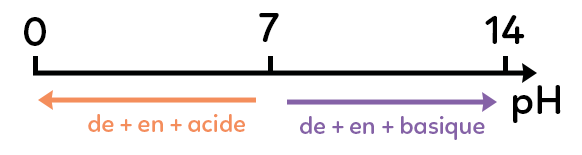
Sur l’échelle de pH représentée ci-dessus les solutions neutres sont situées à 7. Le pH va de 0 à 14.
Plus le pH est petit, plus il va vers 0 et plus la solution est acide.
Plus le pH est grand, de 7 à 14, plus la solution est basique.
Quelle est la composition de ces solutions acides et basiques en termes d’ions ?
Nous étudions l’ion hydrogène H+ et l’ion hydroxyde HO–.
Dans une solution acide, il y a plus d’ions hydrogène H+ que d’ions hydroxyde HO–.
Dans une solution neutre, il y a autant d’ions hydrogène H+ que d’ions hydroxyde HO–.
Dans une solution basique, c’est l’inverse que pour une solution acide, il y a plus d’ions hydroxyde HO– que d’ions hydrogène H+.
Réactions entre les acides et les bases
Si on a une solution acide et qu’on lui rajoute une solution basique, le pH augmente pour atteindre la neutralité (pH = 7).
Si on a une solution basique et qu’on y rajoute une solution acide, le pH diminue de manière à tendre vers la neutralité (pH = 7).
Les réactions entre acides et bases peuvent s’écrire de la manière suivante : H+ + HO– → H2O.
C’est une réaction entre H+ qui est caractéristique de l’acidité et HO– une caractéristique de la basicité.
Réaction acide chlorhydrique et fer
Réaction acide chlorhydrique et fer
I. Expérience
On met de la limaille de fer ou de la poudre de fer et on la recouvre avec de l’acide chlorhydrique. On voit apparaître dans le milieu une coloration verdâtre et un dégagement gazeux. Cela signifie qu’il y a eu une transformation chimique. On tente d’expliquer ce qui s’est passé en regardant ce qu’il y a dans les réactifs et ce qu’il y a dans les produits.
II. Réactifs
Il y a le fer de symbole chimique Fe et on regarde ce qu’il y a dans l’acide chlorhydrique. On fait deux tests :
– Premier test : on rajoute du nitrate d’argent dans de l’acide chlorhydrique et on obtient un précipité blanc. Ce test identifie les ions chlorure Cl–. Donc, dans l’acide chlorhydrique, il y a des ions Cl–.
– Deuxième test : c’est celui du pH. On mesure le pH de l’acide chlorhydrique et on obtient pH = 2. Le pH est inférieur à 7, c’est donc bien un acide. L’ion majoritairement présent dans les acides est l’ion hydrogène H+.
Dans les réactifs on a : des ions H+, des ions Cl– et des atomes de fer Fe.
III. Produits
On fait un premier test qui est celui de l’allumette enflammée. On approche l’allumette du tube à essai où il y a le dégagement gazeux. On entend une légère détonation. Le test est caractéristique de la présence d’un gaz appelé le dihydrogène, de formule chimique H2. On rajoute aussi de la soude dans le milieu réactionnel obtenu et on observe un précipité vert. Ce test est caractéristique de la présence des ions fer II Fe2+. On a créé des ions Fe2+. Et enfin, on fait un troisième test, celui au nitrate d’argent et on obtient un précipité blanc, qui est le test caractéristique des ions chlorure Cl–, comme on avait fait dans les réactifs. A partir de ces tests, on peut écrire l’équation de la réaction.
IV. Équation de la réaction
On écrit le symbole des réactifs, une flèche et le symbole des produits : Fe + H+ + Cl– → H2 + Fe2+ + Cl–.
Les ions chlorure sont présents à la fois dans les réactifs et dans les produits donc on peut les simplifier. On dit que ce sont des ions spectateurs. On a alors : Fe + H+ → H2 + Fe2+.
C’est une réaction qu’il faut équilibrer. On a 1 Fe de chaque côté donc c’est équilibré. Par contre, on a 2 H à droite et 1 H à gauche, on ajoute donc un 2 devant le H+ de gauche.
On a alors l’équation finale de la réaction : Fe + 2H+ → H2 + Fe2+.


