Transformation chimique
On a représenté trois schémas avec : le triangle pour l’entité microscopique qui est contenue dans l’eau, le rond pour l’entité microscopique qui est comprise dans le sucre. A quoi correspondent ces trois transformations ?

Dans la première transformation, on a des entités disposées de manière organisée à gauche et désorganisée à droite, mais les entités n’ont pas changé entre le début et la fin de la transformation. Il s’agit d’une transformation physique qui est la fusion de l’eau par exemple.
Dans la deuxième transformation, on a le sucre à l’état solide ajouté dans de l’eau. On remarque qu’après la transformation, on a un mélange de sucre et d’eau qui est obtenu, mais les entités microscopiques n’ont pas été modifiées entre le début et la fin de la transformation.
Dans la troisième transformation, on a le cas d’une transformation chimique. Le mélange évolue pour donner de nouvelles entités qui n’étaient pas présentes au début. C’est une transformation chimique qui peut se détecter par l’apparition d’un solide, la disparition d’un solide, un dégagement gazeux, un changement de couleur, etc. Il y a différentes façons d’identifier une transformation chimique.
Une transformation chimique peut être écrite avec une équation de la réaction chimique. Les réactifs sont les espèces présentes avant la transformation chimique et les produits les espèces présentes après la transformation chimique. L’équation de la réaction chimique s’écrit de la manière suivante :
réactifs (+) → produits (+).
Exemple : la combustion du carbone
Les réactifs de la combustion du carbone (quand le carbone brûle) sont le carbone et le dioxygène. Le produit est le dioxyde de carbone. L’équation de la réaction chimique s’écrit, en toutes lettres, de la manière suivante : carbone + dioxygène → dioxyde de carbone.
On peut aussi écrire cette équation de la réaction chimique avec les formules chimiques des réactifs et des produits. Dans le cas du carbone, la formule chimique est C. Le dioxygène a pour formule O2 et le dioxyde de carbone CO2. On remarque dans cette équation chimique, et c’est le cas pour toutes les équations de réactions chimiques, qu’il y a le même nombre de carbone dans les réactifs et pour les produits. On remarque qu’il y a le même nombre d’oxygène dans les réactifs et dans les produits. On dit que, pendant une transformation chimique, les atomes se conservent.
Tests d'identification
I. Test d’identification de l’eau
Deux expériences à connaître : un liquide à tester ou un solide à tester.
– Pour un solide à tester, on place le solide dans une coupelle et on rajoute le produit qui permet de tester la présence d’eau et qui s’appelle le sulfate de cuivre anhydre. C’est une poudre blanche, si au contact de l’objet elle devient bleue, cela veut dire qu’il y a de l’eau dans le solide ou l’objet à tester.
– Pour un liquide, on utilise toujours le sulfate de cuivre anhydre mais on le verse cette fois-ci en premier dans la coupelle. On verse ensuite dessus le liquide à tester. Si le sulfate de cuivre anhydre, au contact du liquide, devient bleu, cela veut dire qu’il y a de l’eau dans le liquide à tester. Si le sulfate de cuivre anhydre reste blanc, cela veut dire qu’il n’y a pas d’eau dans le liquide à tester.
II. Test d’identification du dioxyde de carbone
Dans un tube à essai, on met de l’eau de chaux puis on introduit le gaz à tester et on le fait buller dans l’eau de chaux. Si on observe un précipité blanc (solide qui apparaît dans un liquide), cela signifie qu’il s’agit bien du dioxyde de carbone. Si on n’observe pas de précipité blanc dans l’eau de chaux, cela veut dire qu’il s’agit d’un autre gaz.
III. Test d’identification des ions
On utilise encore des réactions chimiques, et notamment l’apparition de précipité.
– Si on place du nitrate d’argent dans une solution à tester et que l’on observe un précipité blanc, cela signifie qu’il y a des ions chlorure Cl– dans la solution. Il s’agit du test d’identification des ions chlorure.
– Si on place de la soude dans une solution à tester et qu’on observe un précipité vert, cela signifie qu’il y a dans la solution des ions Fe2+.
– Si on ajoute de la soude dans une solution à tester et qu’on observe un précipité rouge-orangé, cela signifie qu’il y a dans la solution des ions Fe3+.
– Si on place de la soude dans une solution et que l’on observe un précipité bleu, cela signifie qu’il y a dans la solution des ions Cu2+.
La présence de précipité dans ces tests atteste de la présence des ions. S’il n’y a pas de précipité, c’est que les ions ne sont pas présents ou en trop faible quantité pour être détectés.
Équation de réaction chimique
Une équation de réaction chimique permet d’expliquer les transformations chimiques et elle s’écrit de la manière suivante : réactifs (+) → (donne) produits (+).
I. Exemple : combustion du carbone
L’équation de combustion du carbone est la suivante : C + O2 → CO2.
Donc, le carbone et le dioxygène donnent une molécule de dioxyde de carbone. Avec le modèle moléculaire, on peut représenter la réaction chimique de la manière suivante :
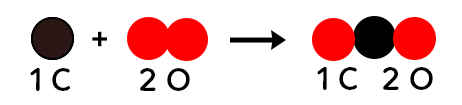
On constate qu’il y a un atome de carbone et deux atomes d’oxygène dans les réactifs. Il y a aussi un atome de carbone et deux d’oxygène dans les produits. C’est le cas dans toutes les réactions chimiques. Il y a exactement le même nombre de chaque type d’atome dans les réactifs et dans les produits. Les atomes présents dans les réactifs se disposent de manière différente pour former le ou les produits.
Cette équation de réaction chimique, on peut l’interpréter de la manière suivante :
1 atome de carbone, réagit avec 1 molécule de dioxygène pour donner 1 molécule de dioxyde de carbone.
Si on avait deux atomes de carbone, on pourrait dire que 2 atomes de carbone réagissent avec 2 molécules d’oxygène pour donner 2 molécules de dioxyde de carbone.
II. Exemple : combustion du dihydrogène H2.
L’équation de la réaction chimique s’écrit de la manière suivante : H2 + O2 → H2O.
On constate avec les modèles moléculaires qu’il y a deux atomes d’hydrogène et deux atomes d’oxygène dans les réactifs. Il y a deux atomes d’hydrogène et un atome d’oxygène dans les produits. On constate que l’équation de la réaction chimique n’est pas équilibrée, puisqu’on n’a pas le même nombre d’oxygène dans les réactifs et dans les produits. Pour l’équilibrer, on rajoute une molécule de dihydrogène dans les réactifs et une molécule d’eau dans les produits. On ne doit pas savoir le faire mais interpréter une équation de réaction qui est équilibrée.
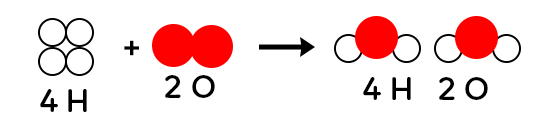
On a donc quatre atomes d’hydrogène dans les réactifs et quatre atomes d’hydrogène dans les produits. On constate qu’il y a deux atomes d’oxygène dans les réactifs et aussi dans les produits. Comment interpréter cette équation de réaction chimique par une phrase ? 2 molécules de H2 vont réagir avec 1 molécule de O2 pour donner 2 molécules de H2O. Si on a 4 molécules de H2 qui réagissent avec 2 molécules de O2, on aura 4 molécules de H2O.


