Formule de Lewis
I. Configurations électroniques stables
Il existe trois atomes dont les configurations électroniques sont stables :
– L’hélium de configuration $He : 1s^{2} $
– Le néon de configuration $Ne : 1s^{2} 2s^{2} 2p^{6}$
– L’argon de configuration $Ar: 1s^{2} 2s^{2} 2p^{6} 3s^{2} 3p^{6}$
Les atomes qui n’ont pas ces structures cherchent à les atteindre. Pour cela, ils peuvent former des ions ou former des liaisons avec d’autres atomes afin de gagner ou de perdre des électrons.
II. Formule de Lewis d’un atome
Lorsqu’un atome forme une liaison avec un autre atome, il gagne un électron. Cette liaison s’appelle liaison de valence ou doublet liant.
|
Atome |
Nombre d’électrons de valence |
Configuration électronique stable |
Nombre de liaisons de valence |
Nombre d’électrons restants |
Nombre de doublets non liants |
Formule de Lewis |
|
C (Z=6) $1s^{2} \underbrace{2s^{2} 2p^{2}}$ |
$4 e^{-}$ |
$Ne : 1s^{2} 2s^{2} 2p^{6}$ |
Il manque $4 e^{-} \Rightarrow$ 4 liaisons |
$4-4=0$ |
0 |
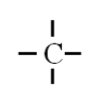 |
|
N (Z=7) $1s^{2} \underbrace{2s^{2} 2p^{3}}$ |
$5 e^{-}$ |
$Ne : 1s^{2} 2s^{2} 2p^{6}$ |
Il manque $3 e^{-} \Rightarrow$ 3 liaisons |
$5-3=2$ |
$\frac{2}{2}=1$ |
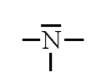 |
|
O (Z=8) $1s^{2} \underbrace{2s^{2} 2p^{4}}$ |
$6 e^{-}$ |
$Ne : 1s^{2} 2s^{2} 2p^{6}$ |
Il manque $2 e^{-} \Rightarrow$ 2 liaisons |
$6-2=4$ |
$\frac{4}{2}=2$ |
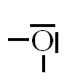 |
|
Cl (Z=17) $1s^{2} 2s^{2} 2p^{6} \underbrace{3s^{2} 3p^{5}}$ |
$7 e^{-}$ |
$Ar: 1s^{2} 2s^{2} 2p^{6} 3s^{2} 3p^{6}$ |
Il manque $4 e^{-} \Rightarrow$ 1 liaison |
$7-1=6$ |
$\frac{6}{2}=3$ |
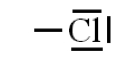 |
|
H (Z=1) $\underbrace{1s^{1}} $ |
$1 e^{-}$ |
$He : 1s^{2} $ |
Il manque $1 e^{-} \Rightarrow$ 1 liaison |
$1-1=0$ |
0 |
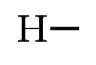 |
Méthode pour trouver la formule de Lewis d’un atome
– Trouver la configuration électronique de l’atome.
– Compter le nombre d’électrons de valence de l’atome.
– Repérer la configuration électronique stable la plus proche.
– Former des liaisons pour obtenir les électrons manquants*.
– Compter les électrons non engagés.
– Former des doublets non liants pour engager les électrons restants (un doublet non liant est une paire d’électrons non engagés).
*Remarque : pour chaque liaison, l’atome gagne un électron dans sa configuration électronique mais il doit engager un électron de valence.
Pour obtenir la formule de Lewis d’une molécule il faut dessiner sa formule développée et rajouter les doublets non liants.


