Titrage avec suivi colorimétrique
Titrage avec suivi colorimétrique
I. Position du problème
A. Titrage
Un titrage c’est la détermination de la concentration, qu’on peut noter C1, en une espèce chimique dans une solution inconnue. Comment fait-on cela ? On réalise une réaction chimique avec l’espèce chimique contenue dans la solution.
B. Suivi colorimétrique
Pour faire le titrage, on sait qu’on fait une réaction chimique et l’objectif est de suivre cette réaction chimique, de savoir où l’on en est dans la réaction. Pour faire cela, dans un suivi colorimétrique, une des espèces chimiques va être une espèce colorée. Soit on aura un produit coloré qui va apparaître, soit un réactif coloré qui va disparaître. Dans tous les cas, il y aura une des espèces chimiques qu’on pourra voir avec nos yeux.
C. Exemple
La solution inconnue, dont on s’intéresse à la concentration, va contenir du diiode (I2) coloré, qui est appelé réactif titré. On va faire réagir I2 avec du S2O32- qui est contenu dans une autre solution : la solution titrante. Ce réactif titrant sera incolore. C’est cette solution titrante que l’on va verser pour titrer la solution inconnue. Dans les produits, on obtient du I– et du S4O62-, qui sont des espèces incolores.
On a l’équation bilan : I2(aq) + 2S2O32-(aq) à 2I–(aq) + S4O62-(aq).
D. Expérimentalement
On va mettre la solution de concentration inconnue (à titrer) dans un bécher et on va en prendre un volume V1. Petit à petit, on va ajouter, grâce à une burette graduée, la solution titrante de concentration connue qui contient du S2O32-. On va en ajouter en tournant le robinet de la burette graduée.
II. Equivalence
A. Définition
On rappelle la réaction qui avait lieu lors du titrage : I2(aq) + 2S2O32-(aq) à 2I–(aq) + S4O62-(aq).
On va d’abord s’intéresser au contenu du bécher.
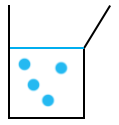
On a représenté quatre molécules de diiode. Dans la réalité, il y en a beaucoup plus, ici la représentation est donnée à titre d’exemple. D’après la réaction, on voit qu’une molécule de diiode réagit avec deux molécules de S2O32-. On va les représenter en rouge :
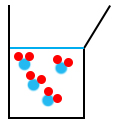
Quand on commence à verser la solution de S2O32-, les molécules de S2O32- vont réagir avec le I2. Au début, le I2 est en excès alors que le S2O32- est le réactif limitant car dès qu’on en ajoute, il est consommé par la réaction. On arrive ensuite à un stade où on a ajouté assez de S2O32- pour qu’il ait réagi avec tout le diiode. On parle alors de proportions stœchiométriques.
À ce stade, il n’y a plus ni de diiode (I2) ni de S2O32- car les deux ont été entièrement consommés. Cet état est appelé : l’équivalence.
Après l’équivalence, si on continue d’ajouter du S2O32-, il ne peut plus réagir avec le diiode (I2) car il n’y en a plus. Donc, le diiode (I2) devient le réactif limitant et le S2O32- le réactif en excès. L’équivalence correspond donc à des réactifs dans les proportions stœchiométriques. C’est l’instant où l’on passe à un changement de réactif limitant. Le réactif limitant du début devient en excès et celui en excès au début devient limitant. Comment repère-t-on ici l’équivalence ? Le diiode (I2) disparaît donc la solution colorée jaunâtre devient incolore.
B. Détermination de C1
C1 est la concentration en quantité de matière de diiode contenue dans la solution inconnue. On rappelle encore l’équation de la réaction : I2(aq) + 2S2O32-(aq) à 2I–(aq) + S4O62-(aq). A l’équivalence, les réactifs ont été ajoutés dans les proportions stœchiométriques. Si on a S2O32- et le diiode dans les proportions stœchiométriques et d’après les nombres stœchiométriques devant chaque espèce, on a :
$n(I_2) = \dfrac{n(S_2O_3^{2-})}{2}$
On sait qu’on a besoin de deux fois moins de diiode dans notre réaction que de S2O32-.
Par conséquent, on a : $C_1.V_1 = \dfrac{C_0V_{eq}}{2}$. Alors, $C_1 = \dfrac{C_0\times V_{eq}}{2V_1}$


