Géométrie des molécules
Géométrie des molécules
I. Représentation des molécules
Dans les représentations des molécules vues jusqu’à maintenant, on a la représentation de Lewis où l’on indique les doublets non liants, la représentation développée où l’on n’indique plus les doublets non liants et la représentation semi-développée où l’on n’indique pas les liaisons entre un C et un H.
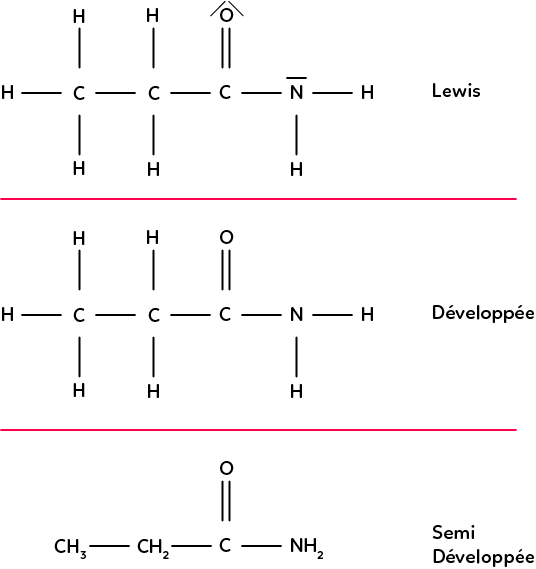
Ces représentations sont en 2D et avec des angles droits entre les liaisons. En réalité, les molécules ont une certaine géométrie dans l’espace.
II. Géométrie dans l’espace
Pour rappel, les doublets liants et non liants sont constitués d’électrons et les électrons ont tendance à se repousser les uns les autres, par conséquent, les doublets liants et non liants vont s’orienter dans l’espace de telle manière à être plus éloignés les uns des autres. On place l’atome central au centre d’un tétraèdre et les doublets liants et non liants vont s’orienter vers les quatre sommets du tétraèdre. C’est la disposition pour que les doublets soient les plus éloignés les uns des autres.
Géométrie de quatre molécules simples
Ces exemples de géométrie peuvent être adaptés à d’autres molécules car on va voir la plupart des cas possibles, notamment pour les molécules qui n’ont pas trop d’atomes.
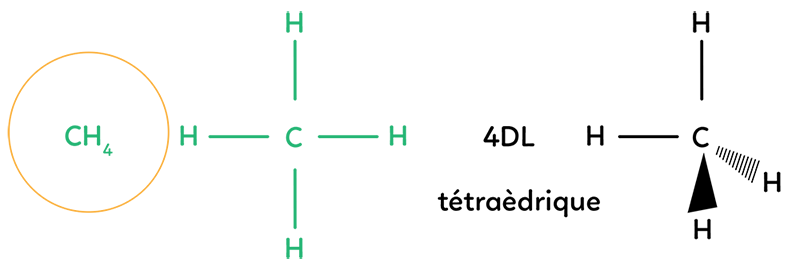
Prenons la molécule de méthane : CH4. On a un atome central le carbone, qui est lié à quatre hydrogènes. On fait quatre doublets liants. On place l’atome de carbone au centre du tétraèdre et les quatre atomes d’hydrogène se disposent autour. Dans l’espace, on représente cette molécule avec deux liaisons hydrogène dans le plan, une liaison hydrogène en avant du plan (représentée par un triangle plein), et la liaison en arrière du plan (représentée par un triangle en pointillés). Cette géométrie de molécule est appelée géométrie tétraédrique.
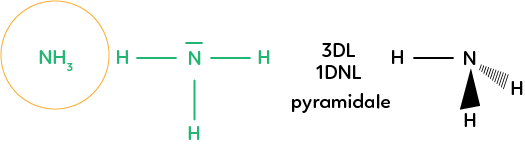
Prenons la molécule d’ammoniac : NH3. On a un atome central d’azote qui a trois doublets liants avec des hydrogènes et un doublet non liant. On ne va donc pas observer le doublet non liant sur la molécule en 3D et on remarque qu’on a une symétrie pyramidale que l’on représente avec un hydrogène dans le plan, un hydrogène en avant et un hydrogène en arrière. On parle alors de géométrie pyramidale puisque cela forme une pyramide.
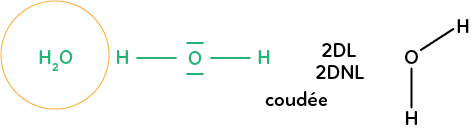
Prenons la molécule d’eau : H2O. On a l’oxygène central qui a deux doublets liants et deux doublets non liants. On a une géométrie de la molécule plane et coudée. Tous les atomes qui seront dans les mêmes configurations que le carbone pour le méthane, l’azote pour l’ammoniac et l’oxygène pour la molécule d’eau auront ce type de géométrie dont il faut connaître les noms.
Prenons la molécule de dioxyde de carbone : CO2. Le carbone central est lié avec deux doubles liaisons à des oxygènes. Dans ce cas, on a une molécule linéaire, sous forme de ligne, et cette molécule aura la même représentation que les représentations classiques vues en début de cours.
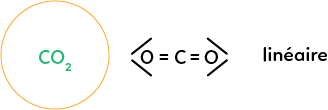
Polarité des molécules
Polarité des molécules
I. Électronégativité
L’électronégativité d’un atome est la tendance à attirer vers lui les électrons lorsque cet atome est engagé dans une liaison covalente. L’électronégativité varie d’une certaine façon dans le tableau périodique. Pour retenir facilement ces variations d’électronégativité dans le tableau périodique, il suffit de retenir que le plus électronégatif est le fluor (F). Ainsi, l’électronégativité augmente de la gauche vers la droite et de bas en haut. Par exemple, le chlore est moins électronégatif que le fluor car il est situé en dessous. Le lithium est moins électronégatif que le fluor car le lithium est situé à gauche et le fluor à droite.
| H | He | ||||||
| Li | Be | B | C | N | O | F | Ne |
| Na | Mg | Al | Si | P | S | Cl | Ar |
La dernière colonne est la colonne des gaz nobles, elle n’est pas considérée lorsqu’on parle d’électronégativité car les gaz nobles sont des espèces stables qui ne créent pas de liaisons covalentes.
II. Liaisons covalentes polarisées
À partir de l’électronégativité, on parle de liaison covalente polarisée. Il s’agit d’une liaison covalente qui engage soit les deux atomes $A$ et $B,$ en sachant que $B$ est plus électronégatif que $A$. $B$ va attirer les électrons vers lui, va attirer la liaison covalente vers lui. Donc, on note sur $B$ une charge partielle négative et par conséquent sur $A$ une charge partielle positive.
\(^{\delta^{+}}A \rightarrow B^{\delta^{-}}\)
On indique $δ^+$ et $δ^-$ pour montrer qu’il ne s’agit pas de charges négatives et positives comme dans les ions. Si on note $A^+$ et $B^-$, cela veut dire qu’il n’y a plus de liaison covalente entre deux et qu’il y a juste les ions $A^+$ et $B^-$. La charge partielle positive et négative est beaucoup moins intense que les charges positives et négatives que l’on trouve dans les ions.
Exemples
La liaison $H-O.$ On remarque que $O$ est à droite du tableau périodique et $H$ à gauche, donc $H$ est moins électronégatif que $O$ et $O$ est plus électronégatif que $H. O$ va attirer les électrons vers lui et il y aura une charge partielle négative sur $O$ et une charge partielle positive du côté du $H.$ Cette liaison va être polarisée.
La liaison $H-H.$ Ce sont les mêmes atomes donc l’un n’attire pas plus les électrons que l’autre, ainsi cette liaison ne sera pas polarisée.
III. Molécules polaires
À partir des liaisons polarisées on peut déterminer si une molécule est polaire ou non (apolaire).
Exemples de l’eau
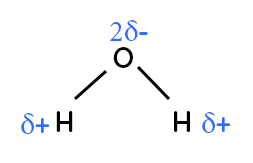
On représente l’eau en tenant compte de sa géométrie, ce qui est très important pour ne pas se tromper quand il faut déterminer si la molécule est polaire ou non. La liaison $H-O$ est polarisée, on a un $δ^-$ sur le $O,$ un $δ^+$ sur le $H.$ De même pour la deuxième liaison $H-O.$ On a donc deux $δ^-$ sur l’oxygène. Cette molécule est polaire puisque le centre des charges partielles négatives est sur l’oxygène et le centre des charges partielles positives est situé entre les deux hydrogènes. On peut donc voir que le pôle négatif est en haut et le pôle positif en bas. Cette molécule est polaire puisque le pôle positif et le pôle négatif ne sont pas situés au même endroit.
Exemple du dioxyde de carbone
Le dioxyde de carbone a une géométrie linéaire. L’oxygène est plus électronégatif que le carbone, on le voit dans le tableau périodique. L’oxygène attire vers lui les électrons, on a une charge partielle négative sur l’oxygène de droite et de gauche. On a deux charges partielles positives sur le carbone puisque les deux liaisons sont polarisées. Le centre positif est au niveau du carbone et le centre négatif est aussi au niveau du carbone, puisque le centre des deux oxygènes est aussi au niveau du carbone. Comme le centre positif et le centre négatif sont au même endroit, cela implique que la molécule n’est pas polaire donc elle est apolaire.
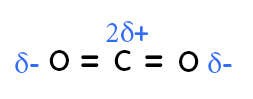
Formule de Lewis des ions
Formule de Lewis des ions
Comment établit-on la formule de Lewis des ions ?
Dans la formule de Lewis, on indique pour chaque atome tous les électrons de valence et ces électrons sont répartis dans des doublets liants ou non liants.
Les formules de Lewis des atomes à connaître par coeur sont les suivants :
Formule de Lewis de $C, H, O, N$ et $Cl$
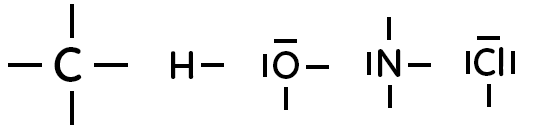
Pour ce qui est des ions, il y en a deux types : les ions monoatomiques et les ions polyatomiques.
Les ions monoatomiques sont des ions formés à partir d’un seul atome, par exemple l’ions chlorure $Cl^-$.
Les ions polyatomiques sont eux formés à partir de plusieurs atomes, par exemple l’ion hydroxyde $HO^-$.
Règles
Pour établir la formule de Lewis, il faut utiliser des règles :
– Quand on passe de l’atome à l’ion, si 1 doublet liant devient non liant, cela fait apparaître une charge négative qui se représente pas un signe moins entouré. Exemples :
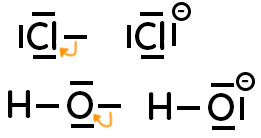
– Quand on passe de l’atome à l’ion, si 1 doublet non liant devient liant, cela fait apparaître une charge positive qui se représente pas un signe plus entouré. Exemple :
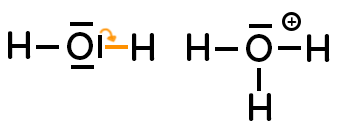
– Pour le cas de l’ion hydrogène $H^+$, il y a une lacune électronique (un électron manquant), on représente un rectangle vide ainsi qu’une charge de vide. Exemple :



