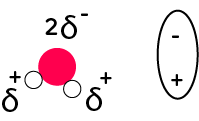Dissolution d'un cristal ionique
Dissolution d’un cristal ionique
Que se passe-t-il lorsqu’on dissout un cristal ionique dans l’eau ?
Pour rappel, la molécule d’eau est une molécule polaire : au niveau de l’oxygène, il y a une zone avec une charge partielle négative et au niveau des hydrogènes, il y a une zone avec une charge partielle positive. On peut modéliser la molécule d’eau de la manière suivante :
Une zone négative au niveau de l’oxygène et une zone positive au niveau des hydrogènes. Cela va nous aider à comprendre comment se passe la dissolution.
La dissolution se déroule en trois étapes : la dissociation, la solvatation et la dispersion.
La dissociation
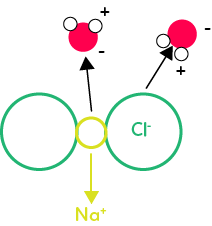
Lors de la dissociation, les molécules d’eau s’approchent des ions du cristal ionique, qui est ici le cristal de sel composé d’une alternance d’ions Chlorure (Cl–) et d’ions Sodium (Na+). Lorsque la molécule d’eau s’approche de l’ion chlorure, elle va présenter le côté où il y a les hydrogènes, c’est le côté positif, et éloigner le côté où il y a l’oxygène puisque c’est le côté négatif. L’ion chlorure va être attiré par la molécule d’eau. Par contre, cela va être l’inverse pour l’ion sodium. La molécule d’eau va s’approcher du côté de l’oxygène qui est une zone négative et mettre à l’opposé les hydrogènes puisque c’est le côté positif. De cette manière, l’ion sodium va être attiré par la molécule d’eau. Progressivement, les molécules d’eau attirent les ions et dissocient le cristal ionique.
La solvatation
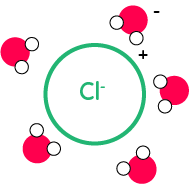
Dans ce phénomène, les molécules d’eau vont entourer les ions après les avoir disloqués du cristal ionique. Les molécules d’eau vont se disposer autour de l’ion chlorure de la manière suivante, puisqu’ici on a les zones positives de la molécule d’eau et à l’opposé la zone négative de la molécule d’eau :
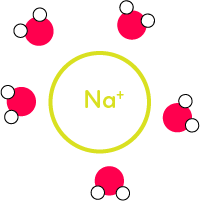
Pour l’ion sodium, c’est l’inverse. Les molécules d’eau vont se disposer autour de l’ion de la manière suivante, puisqu’au niveau de l’oxygène on a une partie négative et une partie positive au niveau des hydrogènes :
La dispersion
Tout se mélange de façon homogène dans l’espace. La dissolution est évidemment favorisée par l’agitation, qui va permettre d’accélérer ce phénomène de dispersion et d’avoir une solution bien homogène.
Équation bilan
L’équation bilan de la réaction, dans le cas du chlorure de sodium ou sel de table, s’écrit de la manière suivante :
$NaCl (s) \rightarrow Na^+ (aq) + Cl^- (aq)$
NaCl, la formule du cristal de sel, donne Na+ et Cl–. On ne fait pas figurer l’eau car elle est toujours présente dans cette dissolution. On indique juste que NaCl, le cristal ionique, se dissocie en ions Na+ solvatés (aqueux), et en ions Cl– solvatés (aqueux).
Voyons maintenant le cas d’un cristal où il n’y a pas seulement un anion et un cation mais où il y a un cation et deux anions : le cristal de formule CaF2. Il va donner un ion Ca2+ (aq) et deux ions fluorure F–(aq).
$CaF_2 (s) \rightarrow Ca^{2+} (aq) + F^-(aq)$
Effectivement, dans la formule du cristal on a deux F– pour un Ca2+ donc on va retrouver le nombre stœchiométrique « 2 » au niveau de l’équation de dissolution. Cela va avoir une conséquence au niveau des concentrations.
Concentration
Effectivement, on a la concentration en soluté apporté notée CCaF2 , c’est le nombre de moles de soluté divisé par le volume de la solution :
$C_{CaF_2}= \dfrac{n_{ CaF_2}}{V_{sol}}$
Elle ne va pas être égale, dans tous les cas, à la concentration en ions réelle présents dans la solution. En effet, quand on dissout un cristal ionique CaF2 on a un ion Ca2+ mais on a deux ions F–. En fait, la concentration en ion Ca2+ va être égale à la concentration CCaF2 :
$[Ca^2+]= \dfrac{n_{Ca^2+}}{V_{sol}} = C_{CaF_2}$
Par contre, on a deux fois plus d’ions F– que de cristaux de CaF2 :
$[F^-]= \dfrac{n_{F^-}}{V_{sol}} = 2 C_{CaF_2}$
Tensioactifs et molécules amphiphiles
Tensioactifs et molécules amphiphiles
I. Définition
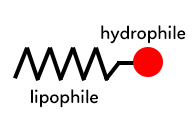
Une molécule amphiphile possède deux parties :
– une partie polaire et hydrophile (qui aime l’eau) ou lypophobe (qui n’aime pas les graisses), soluble dans l’eau.
– une partie apolaire et lipophile (hydrophobe), soluble dans les graisses.
La partie apolaire est représentée par une longue chaîne carbonée en zig-zag et la partie polaire par un rond rouge.
II. Micelles
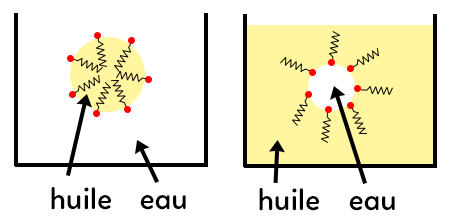
En pratique, les molécules des tensioactifs vont former des micelles lorsqu’il y a un mélange d’huile et d’eau. Quand une goutte d’huile est dans de l’eau, la goutte est stabilisée dans l’eau car les parties lipophiles des molécules amphiphiles sont regroupées dans la goutte d’huile. Les parties hydrophiles sont dans l’eau.
De même, une goutte d’eau dans l’huile sera stabilisée dans l’eau car les parties hydrophiles seront regroupées dans la goutte d’eau et les parties lipophiles dans l’huile qui est ici majoritaire.
Stabilisation des émulsions
Une émulsion est une solution homogène à l’œil nu qui redevient hétérogène après mélange (exemple du mélange huile-eau). En ajoutant des tensioactifs, cela va stabiliser les émulsions, comme pour les tensioactifs de l’œuf pour la mayonnaise par exemple.
Action d’un savon
Les tensioactifs présents dans le savon vont permettre la création d’une micelle pour arracher la tâche de graisse présente sur un tissu. (Le savon place la partie lipophile dans la tâche de graisse et la partie hydrophile à l’extérieur.) La tâche partira ensuite dans les eaux de rinçage.
Cohésion des solides
Cohésion des solides
La cohésion des solides est la manière dont les différentes entités chimiques qui composent un solide tiennent ensemble.
On dit qu’un solide est cohérent lorsque les éléments qui le composent sont « fixés » les uns aux autres. Ce n’est pas le cas d’un liquide ou d’un gaz par exemple, dans lesquels les éléments sont indépendants les uns des autres.
I. Cohésion des solides ioniques
Un solide ionique est constitué d’anions et de cations.
Rappel : un anion est un ion de charge négative et un cation est un ion de charge positive.
Dans un solide ionique, les ions sont disposés de manière à être entourés d’ions de charges opposées : un anion est donc entouré de cations et inversement.
La cohésion du solide s’explique par l’attraction entre cations et anions. Celle-ci résulte de l’interaction électrostatique entre particules de charges opposées.
Remarque : il existe une force répulsive entre les charges de même signe mais elle est moins importante donc le solide est cohérent.
Exemple : le sel est un solide cristallin composé d’ions $Na^+$ et $Cl^-$.
II. Cohésion des solides moléculaires
Un solide moléculaire est composé de molécules. À la différence d’un solide ionique, les entités qui le composent ne possèdent pas de charge.
Cas des molécules polaires
Une molécule polaire est constituée de deux pôles opposés qui présentent des charges partielles. On note ces charges partielles $\delta^+$ et $\delta^-$. Ces charges partielles correspondent à un surplus ($\delta^-$) ou un manque ($\delta^+$) local d’électrons.
Dans ce cas aussi, la cohésion du solide est due à l’interaction électrostatique entre charges opposées mais il s’agit ici de charges partielles.
Cas des molécules apolaires
Dans une moléculaire apolaire, il n’y a pas de charges permanentes. Cependant, l’agitation des électrons au sein du solide crée des zones en surplus ou en manque d’électrons de manière aléatoire. Ces zones donnent lieux à des charges partielles instantanées, c’est-à-dire qu’elles apparaissent et disparaissent au cours du temps mais peuvent se propager d’une molécule à l’autre.
Il y a donc ici aussi une interaction électrostatique qui explique la cohésion du solide.
Pont hydrogène
Un pont hydrogène se forme entre un atome d’hydrogène relié à un atome plus électronégatif que lui, et un doublet non-liant d’un atome portant une charge $\delta^-$.
Remarque : Généralement, l’atome portant le doublet non-liant est un oxygène $O,$ un azote $N,$ un chlore $Cl$ ou un fluor $F.$
Cette interaction est attractive (car l’hydrogène porte une charge $\delta^+$) et renforce la cohésion du solide.
Dans l’eau, des ponts hydrogènes se forment entre les hydrogènes et les oxygènes de molécules différentes et renforcent la cohésion du solide.
Miscibilité, solubilité - Extraction liquide-liquide
Miscibilité, solubilité – Extraction liquide-liquide
I. Miscibilité
Deux espèces sont dites miscibles si elles se mélangent entre elles et ne forment qu’une seule phase.
Exemple : eau et éthanol.
Deux espèces sont dites non miscibles si elles ne se mélangent pas entre elles et forment deux phases distinctes.
Exemple : eau et huile.
II. Solubilité
Un soluté est soluble dans un solvant s’il se mélange, si le mélange est homogène. Le mélange obtenu est appelé une solution. Un soluté peut être solide, liquide ou gazeux. Attention, si le soluté est liquide, il ne faut pas confondre avec la miscibilité : on parle de solubilité si le soluté est en très petite quantité par rapport au solvant. Le solvant est quant à lui toujours liquide.
La solubilité est la quantité maximale de soluté que l’on peut dissoudre dans 1 L de solvant à une température donnée.
Règle : « qui se ressemble s’assemble »
Soluté soluble dans solvant polaire : ions + molécules polaires (exemple : NaCl dans de le solvant eau).
Soluté soluble dans solvant apolaire : molécules apolaires (exemple : le diode dans du cyclohexane).
III. Extraction liquide-liquide
But : Extraire une espèce parmi plusieurs autres espèces dans la solution.
Condition du choix du solvant d’extraction :
– non miscible avec le milieu dans lequel se trouve l’espèce au départ,
– l’espèce à extraire doit être beaucoup plus soluble dans le solvant d’extraction,
– le moins dangereux pour la santé et l’environnement possible.
On utilise ensuite une ampoule à décanter pour extraire l’espèce en question. On peut également faire s’évaporer le solvant extracteur pour ne garder que l’espèce pure.