Acides et bases : réactions A/B
Exercice : Acides et bases : réactions A/B
Questions
1. Représenter les schémas de Lewis des composés suivants :
– ammoniac NH3,
– ion ammonium,
– acide éthanoïque CH3COOH,
– ion éthanoate.
2. Identifier les couples A/B et écrire les demi-équations associées.
Méthode :
– Vérifier qu’on a le même nombre d’atomes à gauche et à droite du symbole « = ».
– Vérifier que la charge est conservée.
– Écrire l’état physique des différentes espèces (aq, gaz, liq).
3. On dispose des solutions aqueuses suivantes : acide éthanoïque, ammoniac, éthanoate de sodium et chlorure d’ammonium.
a. Parmi ces solutions, laquelle pourrait réagir avec la solution d’ammoniac ? Justifier. Donner l’équation de la réaction.
b. Laquelle de ces solutions pourrait réagir avec la solution d’éthanoate de sodium ? Pourquoi ? Donner l’équation de la réaction.
Acides et bases : jus de citron
Exercice : Acides et bases : jus de citron
Énoncé
En cuisine, le jus de citron est souvent utilisé pour camoufler l’odeur du poisson du plat. Cette odeur émanant du poisson est principalement due à la triméthylamine (CH3)3N qui est une amine très volatile. On sait que sous la forme acide cette amine n’est plus odorante.
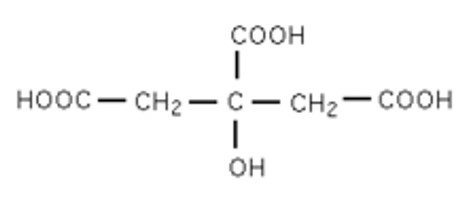
Voici la formule de l’acide citrique :
Le jus de citron contient environ 6 g d’acide citrique C6H8O7 (aq) pour 100 g de jus de citron. C’est un triacide.
Questions
- Identifier les groupes caractéristiques de l’acide citrique et de la triméthylamine (CH3)3N.
- Pourquoi cette dénomination de « triacide » ?
- Donner les 3 couples A/B responsables issus de l’acide. Pour simplifier l’écriture, on note le triacide AH3.
- Parmi ces espèces appartenant à ces couples certaines sont dites amphotères. Préciser lesquelles.
- Justifier l’usage du jus de citron en cuisine en vous basant sur l’équation de la réaction.
Rappel :
Une espèce amphotère est une espèce qui possède à la fois des propriétés acides et basique.
Acides et bases : réaction totale
Exercice : Acides et bases : réaction totale
Énoncé
Le pH d’une solution de 100 mL d’acide éthanoïque CH3COOH (aq) de concentration C = 10-2 mol.L–1 vaut 2.8.
Questions
1. Donner l’équation de la réaction de l’acide éthanoïque avec l’eau.
Méthode :
– Écrire les différents couples AB qui interviennent sans oublier les couples de l’eau.
– Écrire les équations de demi-réactions associées.
– Sommer les demi-équations pour obtenir l’équation bilan.
– Ne pas oublier de mettre les états physiques des espèces chimiques.
Remarque : Une réaction AB se produit entre la base d’un couple et l’acide d’un autre couple.
2. Établir le tableau d’avancement de cette réaction et déterminer la quantité de matière initiale d’acide.
3. Quelle est la quantité de matière maximale de n(H3O+) qui peut être formée ? Donner le pH théorique.
Rappel :
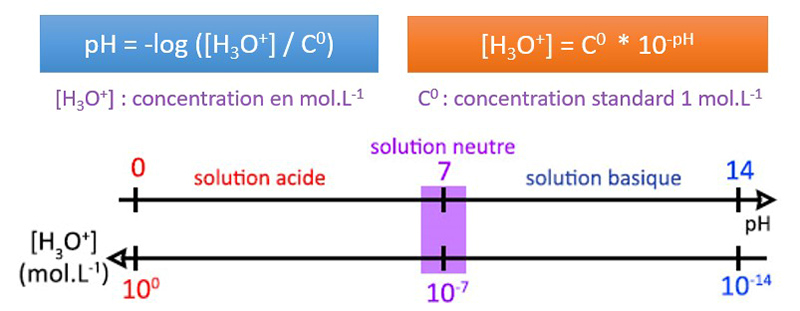
pH = en solution aqueuse, le pH est une grandeur sans unité pouvant caractériser l’acidité d’une solution.
4. Conclure sur le caractère total de la réaction.
Rappel :
Réaction totale : l’un des réactifs initialement introduit a été totalement consommé au cours de la réaction. D’où le formalisme de flèche unique lors de l’écriture de la réaction de l’équation.
Acides et bases : identification de couples A-B
Exercice : Acides et bases : identification de couples A-B
Questions
1. Identifier les couples A/B parmi les couples suivants en écrivant les demi-équations associées :
a) H3O+ (aq) / H2O (l)
b) H2O (l) / HO– (aq)
c) HgO (g) / Hg (l)
d) HNO3(aq) / NO3-
e) H+ (aq) / H2 (g)
f) Fe3+ (aq) / Fe2+ (aq)
g) CH3CH2OH / CH3CH2O–
Rappels :
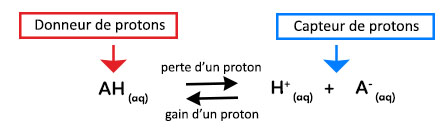
Acide : Selon la définition de Brönsted, un acide est une espèce chimique capable de céder un ou plusieurs protons H+.
Base : Une base est une espèce capable de capter un ou plusieurs protons H+.
Un acide et une base sont « conjugués » s’ils sont reliés par la demi-équation suivante :
L’acide conjugué et la base conjuguée forment un couple A/B noté AH(aq)/A–.
Réaction acido-basique : réaction d’échange d’un ou plusieurs protons H+ entre l’acide d’un couple et la base d’un autre couple.
Acide 1 / Base 1
Acide 1 + Base 2 = Acide 2 + Base 1
Acide 2 / Base 2
Méthode :
- Vérifier qu’on a le même nombre d’atomes à gauche et à droite du symbole « = ».
- Vérifier que la charge est conservée.
- Écrire l’état physique des différentes espèces (aq, gaz, liq).
2. Parmi les espèces présentes, identifier une espèce amphotère et écrire l’équation de la réaction de l’espèce avec elle-même.
Rappel : Une espèce amphotère est une espèce qui possède à la fois des propriétés acides et basiques.
3. Compléter les couples A/B en représentant les formules de Lewis associées.
Cinétique : mécanisme réactionnel
Exercice : Cinétique : mécanisme réactionnel
Énoncé
Les esters sont des composés chimiques qui sont à l’origine de l’odeur agréable des fruits. Également utilisés pour les arômes synthétiques en parfumerie.
On s’intéresse à la cinétique de l’estérification de l’éthanoate d’éthyle, responsable de l’odeur du rhum et des raisins endommagés.
Questions
1. Représenter la formule de Lewis de l’éthanoate d’éthyle.
2. Cet ester est synthétisé à partir d’un acide carboxylique (l’acide éthanoïque) et de l’éthanol. On observe qu’il se forme de l’eau au cours de la réaction de synthèse.
a) Donner l’équation de la réaction.
b) Identifier les différents groupes caractéristiques.
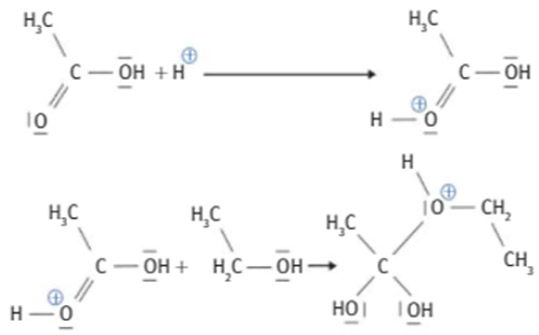
3. Voici les 2 premières étapes du mécanisme réactionnel :
a) Justifier que l’étape 1 est une réaction A/B. Identifier le couple A/B.
b) Recopier le mécanisme et rajouter des lacunes électroniques et les doublets en respectant les règles de Lewis.
Représenter le mécanisme avec les flèches courbes.
c) Identifier l’Intermédiaire réactionnel (IR).
Rappels :
AE (acte élémentaire) : réaction dont le bilan macroscopique traduit exactement le déroulement de la réaction à l’échelle moléculaire. Se déroule en une étape.
IR (intermédiaire réactionnel) : entité chimique qui n’apparaît ni parmi les réactifs ni parmi les produits dans l’équation bilan mais participe à des mécanismes réactionnels. Formé au cours d’un AE et consommé au cours d’un autre AE.
d) Au cours de 3 autres AE (actes élémentaires), l’ion H+ est reformé. Qualifier cette espèce.
Rappels :
Facteur cinétique : paramètre qui influe sur la vitesse d’évolution d’une réaction (T0, [C] en réactifs, catalyseur, pression).
Catalyseur : espèce chimique permettant d’accélérer la réaction. Le même état final est atteint plus rapidement. Espèce qui n’apparaît pas dans l’équation bilan. Il est consommé au début de la réaction et est régénéré en fin de réaction. Concrètement, une étape lente sera transformée en plusieurs étapes (AE) rapides.
Cinétique : bouteille de jus
Exercice : Cinétique : bouteille de jus
Énoncé
L’étiquette d’une bouteille de jus nous indique que celle-ci contient 50 g de sucre pour 500 mL.
Le saccharose qui est le nom scientifique du sucre de formule brute C12H22O11 se dégrade totalement au contact de l’eau pour former en quantité stœchiométriques du fructose et du glucose qui sont deux sucres ayant chacun des formules brutes C6H12O6.
Données : M(C) = 12 g.mol-1 M(H) = 1 g.mol-1 M(O) = 16 g.mol-1
|
Temps t (s) |
0 |
0.5 * 106 |
1 * 106 |
2 * 106 |
2.5 * 106 |
|
Concentration en fructose (mol.L-1) |
0 |
7.6 * 10-2 |
1.3 * 10-1 |
2.1 * 10-1 |
2.3 * 10-1 |
Questions
1. Donner l’équation de la réaction du saccharose avec l’eau.
2. Calculer la quantité de matière en saccharose dans la bouteille. En déduire la concentration finale en fructose.
3. À l’aide d’un programme python, représenter l’évolution de la concentration de fructose en fonction du temps.
4. Déterminer le temps de demi-réaction t1/2 à partir de la concentration finale en fructose. Commenter t1/2.
Rappel :
Temps de demi-réaction t1/2 (en s) : correspond au temps au bout duquel l’avancement a atteint la moitié de sa valeur finale.
On remarque que le temps d’hydrolyse de la moitié du saccharose est très inférieur au temps de conservation de la bouteille.